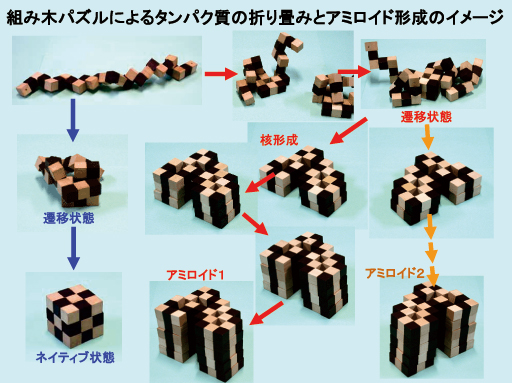
蛋白のフォールディング
蛋白質は、主にある決まった構造を持ち機能することが知られています(そうでない蛋白もあります)。構造を持つにいたる過程を「折りたたみ、folding」と言います。何かのきっかけで折りたたみ方が異なると、本来とは異なったものとなってしまします。アミロイド線維はまさにそれで、通常とらない構造をとっています。この積木のおもちゃは、蛋白質の折りたたみがどういったものなのかを直感的に知るのに便利です。
Protein folding
It is known that proteins mainly have a certain structure and function (some proteins do not). The process of forming a structure is called "folding". If the folded structure is wrong for some reason, the fundtion will be different from the original. Amyloid fibrils fold in a different way from native structure and have a different structure. This building block toy is useful to intuitively understand what protein folding looks like.
エコカイロ
私たちの研究室では「過飽和」というキーワードに着目し、蛋白質の凝集がどのような環境で起こっているのかを研究しています。エコカイロは酢酸ナトリウムの過飽和溶液と1つの小さな金属(パチン)が入ったもので、パチンを"パッチン"とすると溶液が瞬く間に結晶が析出しだします。私たちの体の中でもパチンのようなモノや状態が起きたときに過飽和状態の蛋白質が析出することにより、結晶やアミロイド線維などの蛋白質の析出が生じるのではないかと考えています。
Eco warmer
In our laboratory, we focus on the keyword "supersaturation" and study the environment in which protein aggregation occurs. Eco warmers contain a supersaturated solution of sodium acetate and one small metal, and if the metal is clicked, crystals will start to precipitate in a blink of an eye. It seems that the precipitation of proteins such as crystals and amyloid fibrils may occur due to the precipitation of supersaturated proteins when things or conditions like the metal click occur in our body.
蛋白質の酸変性
蛋白質は一般的に、酸変性する(酸性になると変性する)ことが知られています。動画の溶液はシトクロムcという蛋白質が溶解したものです。シトクロムcの溶液は、シトクロムcが天然構造をとるとき赤色をしていますが、溶液を酸性にしていくと(一番右の瓶:HClを加えていくと)蛋白質が変性し、溶液の色が変色します。蛋白質の変性を目で見て知ることができます。シトクロムcのさらにおもしろいところは、その変性の反応が可逆的であるということです。酸性にすると褐色になり蛋白が変性したことが分かりますが、NaOHを加えて(一番左の瓶)溶液のpHを中性に戻すと再び赤色に戻ります。そして、それは何度も繰り返すことができます。
Acid denaturation of proteins
It is generally known that proteins are acid-denatured (when a solution becomes acidic, proteins are denatured). The solution in the video is a solution cytochrome c. The solution of cytochrome c is red when cytochrome c has a native structure, but as the solution is made acidic (right bottle: when HCl is added), the protein denatures and the color of the solution changes. You can visually see the denaturation of proteins. What is more interesting about cytochrome c is that its denaturing reaction is reversible. It can be seen that acidification made it brown and the protein denatured, but when NaOH is added (left bottle) to return the pH of the solution to neutral, it turns red again. It can be repeated many times.
