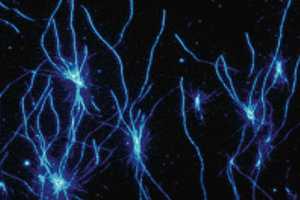
近年、蛋白質の天然構造が壊れたり、間違ったフォールディング(ミスフォールディング)をすることが原因で病気が引き起こされる例が多く見つかり、フォールディング病(folding disease)と呼ばれて注目されています。その代表がアミロイドーシスです。アミロイドーシスは、蛋白質が凝集してアミロイド線維と呼ばれる規則的な線維状構造を形成して、組織に沈着する病気の総称です。ヒトでは約20種類のアミロイドーシスが知られており、アルツハイマー病やプリオン病など、今日、社会問題になっている病気も含まれます。
私たちは、そのような病気を引き起こすアミロイド線維がどのようにしてできるのか、どのような化合物が線維の形成を促進したり阻害するのか、できたアミロイド線維はどのような性質を持っているのかなどを様々な手法を用いて調べています。また、「蛋白質の凝集」に着目し、アミロイド線維だけでなくアモルファス凝集といった不規則な蛋白凝集とアミロイド線維のような規則的な蛋白凝集がどのような経路で出来るのかについても興味をもち研究を進めています。
In recent years, many diseases caused by denaturation of native structure or incorrect folding (misfolding) have been found, and it is called a folding disease and attracts attention. The representative is amyloidosis. Amyloidosis is a general term for diseases in which proteins aggregate to form an ordered fibrillar structure called amyloid fibrils and deposited in tissues. More than 20 types of amyloidosis are known in humans, including Alzheimer's disease, prion disease, and other diseases that are currently becoming a social problem.
Using various methods, we investigate how amyloid fibrils cause such diseases, what compounds promote or inhibit fibril formation, and what properties the amyloid fibrils formed have. Focusing on "protein aggregation," we are also interested in and studying the routes by which non-ordered aggregates, amorphous aggregates, as well as ordered amyloid fibrils, form.
私たちは主に次の実験方法(分光計・超音波・熱量測定・顕微鏡・NMR)を用いて、アミロイド線維、蛋白質凝集についての研究を行っています。
We investigate amyloid formation and protein aggregation using following methods.Spectrometer, Ultrasonicator, Microscopy, Calorymetry, NMR
分光計
アミロイド線維がどのようなタイムスケールで出来るのか、できたあとはどういう構造を持っているのかなどを調べるには、それぞれに適した分光計を用います。
アミロイド線維に特異的に結合することにより蛍光を発するチオフラビンTの蛍光量を測定することにより、どれくらいの時間でどれくらいの線維ができているのかを見積もるためには、蛍光を定することのできる装置を用います。
モノマーの構造や反応後の構造がランダム構造なのか、αへリックスなのか、βシートなのかなどを調べたいときには円二色性を調べます。このときにはCDという装置を用います。
Spectrometer
To find out what kind of time scale amyloid fibrils form and what kind of structure they have, use a spectrometer suitable for what you want to know.
By measuring the fluorescence intensity of thioflavin T, which emits fluorescence when it specifically binds to amyloid fibrils, using a fluoremeter, it is possible to to estimate how many fibrils form.
When you want to find out what kind of structure, such as random structure, α-helix, and β-sheet, the monomer or the products have, you should examine circular dichroism using CD spectrophotometer.
超音波
線維形成は、核形成と線維伸長という2段階の反応でなっています。核形成には数時間~数日といった時間が必要であり、そのため実験の数をこなしたり、多くのサンプルを用いて統計的な処理をすることが難しいという問題がありました。
私たちの研究室では、超音波が核形成を促進することを見出しました。超音波を用いることにより、1つの実験にかかる時間が減少するだけではなく、プレートリーダーとの併用でサンプルに必要な蛋白質量を減らし、また統計的な処理ができるような実験を短期間でできるようになりました。
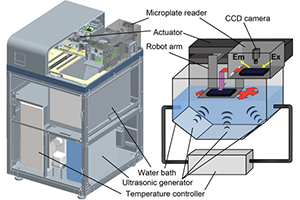
また、超音波とプレートリーダーを組み合わせた装置HANABIも開発し、より一層、蛋白質凝集のメカニズムにせまる研究をすすめていけるような環境となっています。
Ultrasonication
Fibril formation is a two-step reaction consisting of nucleation and elongation. Nucleation requires several hours to several days, which makes it difficult to perform a large number of experiments and perform statistical processing using a large number of samples.
In our lab, we found that ultrasonication promotes nucleation. By using ultrasonication, not only the time required for one experiment can be reduced, but also the amount of protein required for the sample can be reduced in combination with a plate reader, and also an experiment that allows statistical processing can be performed in a short period of time. In addition, we have developed an instrument "HANABI" that combines an ultrasonicator and a plate reader, and we can further promote research focusing on the mechanism of protein aggregation.
熱量計
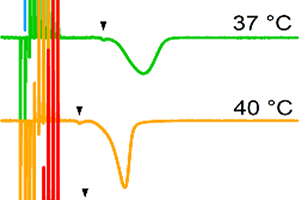
モノの結合には熱が発生したり、熱の吸収がみられます。それは蛋白質が構造をとる(フォールディングする)ときにも同じことが言えます。これまで、蛋白質のフォールディングに関して、どれくらいの熱が出るのかといった研究が多くされてきました。しかし、蛋白質が凝集する際の熱測定は、蛋白質の凝集が起きると溶液が濁るなどの難しさから、積極的にされてきませんでした。
私たちの研究室では、近年、等温滴定熱量計(ITC)を用いてアミロイド線維ができる際の熱測定に成功しました。この方法を用いて、様々なアミロイド線維になる蛋白質がアミロイド線維になるときにどのような熱を出すのか(熱を吸収するのか)や、アモルファス凝集とアミロイド線維になるときの熱の違いなどに着目した研究を行っています。
Calorymetry
Heat is generated or absorbed in the binding of things. The same can be said when proteins adopt structure (folding). So far, much research has been done on how much heat is generated in protein folding. However, the heat measurement for protein aggregation has not been positively performed due to the difficulty of the solution becoming cloudy when protein aggregation occurs.
In recent years, our laboratory has succeeded in measuring the heat of amyloid fibril formation using an isothermal titration calorimeter (ITC). This method is used to determine what kind of heat various proteins that become amyloid fibrils emit (absorb) when they become amyloid fibrils, and to identify the difference between the heats of amorphous aggregation and amyloid fibril formation.
顕微鏡
どのような形態の線維ができたかを知りたいときには、種々の顕微鏡を用います。
私たちの研究室には原子力顕微鏡(AFM)、全反射蛍光顕微鏡(TIRFM)があり、蛋白質研究所には電子顕微鏡(TEM)があり使用することができます。反応条件により、線維の長さや太さがどのように異なるのかを調べることができるだけでなく、TIRFMを利用すればリアルタイムでの線維形成を観察することができます。様々なスケールでみることのできる顕微鏡を利用し、実験でできた線維の形態を確認しています。
Microscopy
When you want to know what kind of morphology the fibrils have, use various microscopes. We use atomic force microscope (AFM), total internal reflection fluorescence microscope (TIRFM), and transmission electron microscope (TEM). In addition to investigating how fiber length and thickness differ depending on reaction conditions, TIRFM can be used to observe fiber formation in real time. Using a microscope that can be seen on various scales, we confirm the morphology of the fibrils produced in the experiment.
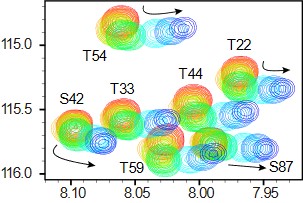
溶液・固体NMR
アミノ酸レベル、原子レベルで蛋白質同士や化合物との相互作用を知りたいというときには、NMRを用います。蛋白質研究所には優れたNMRが多くあり、それを利用することができます。
アミロイド線維がどのような構造を持っているのかを知りたいときには、アミロイド線維自体が凝集物であり溶液中に溶解しないために固体NMRを用います。私たちの研究室では、蛋白質研究所藤原研と共同研究をしており、蛋白質がどのように折りたたまれて線維になっているのかを原子レベルで明らかにしようと研究を進めています。
solution/solid-state NMR
When you want to know the interaction between proteins and compounds at the amino acid level and atomic level, use NMR. There are many excellent NMR in the Institute for Protein Research, and you can use them.
If you want to know what structure amyloid fibrils have, use solid-state NMR because amyloid fibrils themselves are aggregates and do not dissolve in solution. In our laboratory, we are conducting joint research with Fujiwara Lab, Institute for Protein Research, and are conducting research to clarify how proteins are folded into fibers at the atomic level.